Gruppo IMER - Regione Emilia Romagna - NewsLetter 22
IPOSPADIA: 20 anni di sorveglianza
L’ipospadia è una delle più comuni malformazioni congenite del tratto urogenitale, con una prevalenza media alla nascita stimata di 1-2 per 1000 nati (o 2-4 per 1000 nati maschi) (1-3). Tale prevalenza può essere sottostimata sia per la mancata segnalazione alla nascita delle forme più lievi sia per le caratteristiche di reclutamento proprie di alcuni registri di malformazioni congenite.
L’ipospadia risulta dalla incompleta fusione delle pieghe uretrali e/o dalla mancata canalizzazione del cordone epiteliale solido del glande, con conseguente anomala localizzazione del meato uretrale che risulta situato in posizione ventrale e prossimale rispetto all’apice del glande (1-2).
In considerazione della posizione del meato, l’ipospadia viene suddivisa in: I° grado: quando il meato uretrale si apre nel III° distale del pene (include le forme glandulari e coronali); II° grado quando il meato è situato nel III° medio (il cui limite prossimale è costituito dalla giunzione penoscrotale); III° grado se l’apertura uretrale è situata in posizione scrotale o perineale.
Le forme distali (di I°grado) sono le più frequenti e costituiscono circa il 70-85% dei casi riscontrati alla nascita (1-2).
Le malformazioni più frequentemente associate a ipospadia riportate in letteratura sono il criptorchidismo e le anomalie del tratto genitourinario, in particolare per le forme di ipospadia di grado severo (1-2).
Eziologia
Sebbene in passato sia stato ipotizzato che l’ipospadia fosse dovuta ad un singolo gene a trasmissione autosomica dominante a bassa penetranza o autosomica recessiva con espressività incompleta, attualmente l’ipotesi più accreditata è che si tratti di una condizione multifattoriale (o complessa) ove l’interazione tra fattori genetici e l’esposizione ad agenti ambientali determina l’insorgenza della malformazione (4-8). Mutazioni in geni implicati nello sviluppo dei genitali esterni maschili tra cui quelli coinvolti nei difetti della biosintesi del testosterone, della 5-alfa-riduttasi tipo 2 e del recettore degli androgeni sono stati recentemente individuati in alcune famiglie (9-12).
Lo sviluppo dei genitali esterni nel maschio è sotto il controllo degli steroidi sessuali prodotti dal testicolo fetale, controllato a sua volta dalla ipofisi fetale e dalla placenta. Vi sono perciò differenti meccanismi che possono alterare la normale mascolinizzazione dei genitali: alcuni possono agire alterando la produzione, l’azione o il bilancio degli ormoni endogeni, altri possono agire attraverso l’interazione con ormoni esogeni o con "endocrine disrupting chemicals" (quali xenoestrogeni e antiandrogeni) (13-15).
Diversi studi epidemiologici hanno valutato il ruolo degli ormoni endogeni focalizzando l’attenzione sull’età del menarca, l’irregolarità dei cicli mestruali, la parità, l’età materna al concepimento, precedenti aborti spontanei e la minaccia d’aborto (1-2, 16-20). E’ stato osservato un incremento di rischio in giovani primipare (3), ma anche una maggior frequenza di forme severe di ipospadia in donne con età superiore ai 35 anni (21).
L’uso di ormoni esogeni assunti a scopo contraccettivo nel corso del I° trimestre di gravidanza e l’uso di progestinici a scopo antiabortivo è stato correlato ad un più alto rischio di ipospadia (22-24). Una metanalisi di 14 studi sull’esposizione ad ormoni sessuali nel corso del I° trimestre di gravidanza non ha evidenziato un aumento di rischio per anomalie dei genitali esterni (16).
Attualmente è stata posta particolare attenzione agli "endocrine disrupting chemicals", agenti esogeni che interferiscono con la produzione, il rilascio, il trasporto, il metabolismo, il legame, l’azione o l’eliminazione di ormoni naturali responsabili del mantenimento dell’omeostasi e della regolazione dei processi di sviluppo, quali PCBs, diossina, furani, pesticidi organoclorati e anche fitoestrogeni assunti con la dieta (derivati della soia) (25-29).
Uno studio su nati da donne vegetariane, esposte maggiormente a fitoestrogeni (28), ha evidenziato un aumento significativo di ipospadia a supporto della possibilità che i fitoestrogeni possano interferire con lo sviluppo del sistema riproduttivo maschile.
Recenti studi effettuati su nati da fecondazione assistita con ICSI hanno evidenziato un incremento di ipospadia rispetto alla popolazione generale (30-34). Tale rischio dopo ICSI è stato correlato alla presenza di anomalie testicolari e alla subfertilità paterna con un background genetico. Anche il trattamento ormonale materno connesso alla fecondazione assistita è stato ipotizzato essere un fattore di rischio di ipospadia.
E’ emerso infine che l’esposizione ad alcuni antiepilettici e in particolare all’acido valproico è associato ad incremento di ipospadia (35-38).
Casistica IMER (1980-1999)
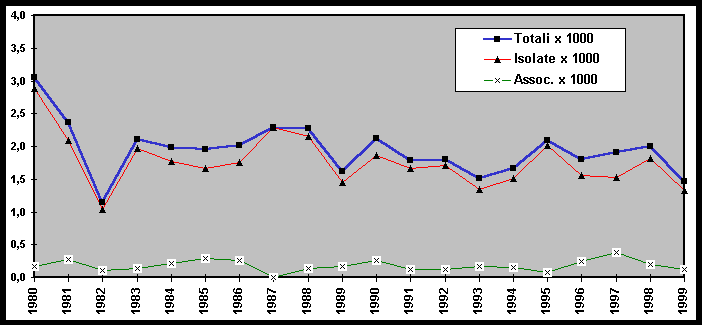
Nel periodo di studio (1980-1999), sono stati accertati 879 neonati con ipospadia fra 459.039 nati totali sorvegliati (maschi e femmine). La prevalenza alla nascita risulta 1,9x1000 ed è in accordo con i dati della letteratura.
Nel tempo considerato non si sono osservate variazioni significative nella prevalenza sia per le forme isolate che per le forme associate.
Andamento temporale (1980-1999) della prevalenza alla nascita dell’ipospadia
L’analisi della distribuzione per provincia di nascita viene riportata in tabella 1. E’ stata osservata una differenza statisticamente significativa nella prevalenza alla nascita nelle diverse provincie della regione (P<0,01).
Tabella 1: ripartizione per provincia di nascita
|
Provincia di nascita |
I° grado |
II° grado |
III° grado |
NOS |
Totale |
Nati 80-99 |
Prevalenza x 1000 |
|
Piacenza |
54 |
7 |
6 |
1 |
68 |
32.610 |
2,1 |
|
Parma |
87 |
29 |
6 |
1 |
123 |
49.865 |
2,5 |
|
Reggio Emilia |
30 |
5 |
5 |
5 |
45 |
45.775 |
1,0 |
|
Modena |
108 |
13 |
3 |
5 |
129 |
75.250 |
1,7 |
|
Bologna |
159 |
40 |
12 |
7 |
218 |
107.156 |
2,0 |
|
Ferrara |
89 |
8 |
8 |
4 |
109 |
42.748 |
2,5 |
|
Ravenna |
58 |
12 |
2 |
6 |
78 |
39.313 |
2,0 |
|
Forlì/Rimini |
72 |
20 |
4 |
9 |
105 |
63.364 |
1,7 |
|
San Marino |
2 |
2 |
4 |
2.958 |
1,4 |
||
|
Totale |
659 |
134 |
48 |
38 |
879 |
459.039 |
1,9 |
Nei casi con grado di ipospadia nota si osserva una diversa percentuale di distribuzione della severità di ipospadia (II° e III° grado) in alcune provincie: Parma (29%), Reggio E. (25%) e Forlì (25%).
Sono in atto progetti in collaborazione con l’ARPA (Agenzia Regionale Prevenzione e Ambiente dell’Emilia Romagna) e con l’Istituto di Fisiologia Clinica del CNR di Pisa per effettuare una valutazione tra le malformazioni congenite e l’esposizione a pesticidi.
La casistica è stata ripartita in condizioni isolate (793; 90,2 %), multiple (MCA: 74; 8,4%), note (6; <1%) e cromosomiche (6; <1%).
Negli 841 casi con grado di ipospadia nota, 659 (78,3%) sono di I° grado; 134 (16,0%) di II° grado e 48 (5,7%) di III° grado (Tabella 2). La frequenza delle ipospadie in base al grado di severità è in accordo con i dati di letteratura. Le ipospadie di grado più elevato (II° e III°) risultano presenti con frequenza statisticamente significativa (P<0,05) nelle condizioni in cui l’ipospadia è associata ad altri difetti.
Tabella 2: Ipospadie e grado di severità
|
Condizioni |
I° grado |
II° grado |
III° grado |
NOS* |
Totale |
|
|
Isolate |
606 |
117 |
40 |
30 |
793 |
|
|
MCA |
48 |
13 |
7 |
6 |
74 |
|
|
Condizioni note |
3 |
1 |
1 |
1 |
6 |
|
|
Cromosomiche |
2 |
3 |
- |
1 |
6 |
|
|
Totale |
659 |
134 |
48 |
38 |
879 |
|
*NOS: non specificate
I casi di ipospadia associati con anomalie multiple sono stati suddivisi per categorie di difetti e per grado di severità.
120 malformazioni sono riscontrate tra 74 nati con MCA: 35 anomalie dell’apparato cardiovascolare (tra cui 15 DIV e 9 DIA), 21 anomalie del tratto urogenitale (tra cui 17 dell’apparato urinario e 4 di criptorchidismo), 14 anomalie degli arti (tra cui 6 difetti in riduzione e 4 polidattilie), 10 altre anomalie muscoloscheletriche, 9 malformazioni del sistema nervoso centrale, 7 anomalie dell’orecchio, 7 malformazioni del tratto gastrointestinale, 3 labio/palatoschisi, 1 anomalia oculare e 7 altre anomalie (Tabella 3).
Tabella 3: malformazioni associate in 74 nati con anomalie multiple (MCA)
|
Difetti |
I° grado |
II° grado |
III° grado |
NOS |
Totale |
|
SNC |
5 |
- |
2 |
2 |
9 |
|
Occhio |
- |
- |
1 |
- |
1 |
|
Orecchio |
4 |
3 |
- |
- |
7 |
|
Faccia, collo |
2 |
2 |
- |
- |
4 |
|
Cardiovascolare |
22 |
6 |
4 |
3 |
35 |
|
Sistema respiratorio |
1 |
- |
- |
1 |
2 |
|
Labio/palatoschisi |
1 |
1 |
- |
1 |
3 |
|
Sistema gastroenterico |
4 |
1 |
1 |
1 |
7 |
|
Criptorchidismo |
1 |
2 |
1 |
- |
4 |
|
Sistema urinario |
9 |
4 |
2 |
2 |
17 |
|
Muscoloscheletrico |
9 |
1 |
- |
10 |
|
|
Arti |
8 |
2 |
2 |
2 |
14 |
|
Altre |
6 |
1 |
- |
- |
7 |
|
Totale |
72 |
23 |
13 |
12 |
120 |
Nella nostra casistica l’ipospadia risulta prevalentemente associata alle anomalie dell’apparato cardiovascolare, del tratto urogenitale e arti-muscoloscheletrico.
Tra le condizioni a eziologia nota sono stati rilevati: 2 casi di associazione di VATER, una sequenza di Pierre-Robin, una sindrome di Treacher-Collins, un’acondroplasia e un caso di rosolia congenita.
Si sono riscontrati 6 casi di anomalie cromosomiche: una sindrome di Down, una trisomia 13, una sindrome di Wolf-Hirschhorn (4p-); due trisomie parziali (12p e 8q) e un mosaicismo 45,X/46,XY rilevato in diagnosi prenatale (Tabella 4).
Il cariotipo è stato effettuato inoltre in 80 casi con ipospadia. A conferma dei dati della letteratura anche nella nostra casistica i casi con ipospadia isolata generalmente non hanno anomalie del cariotipo costituzionale.
Tabella 4: frequenza dell’analisi citogenetica
|
Condizioni |
Non eseguito |
Eseguito |
Totale |
|
Isolati |
733 |
60 |
793 |
|
MCA |
55 |
19 |
74 |
|
Sindromici |
5 |
1 |
6 |
|
Totale |
793 |
80 |
873 |
Desideriamo inoltre ricordarvi che il giorno 18 Maggio 2002 a Ferrara si terrà il:
XVII Convegno Annuale IMER
"Le malformazioni craniofacciali"
Bibliografia