17 anni di sorveglianza delle cardiopatie congenite in Emilia Romagna(1978-1994)
Le anomalie congenite rappresentano la principale causa di morte in epoca perinatale nei paesi sviluppati; le malformazioni cardiache e dei grossi vasi sono tra le più frequente anomalie congenite e possono comportare importanti conseguenze dal punto di vista medico, psico-sociale ed economico.
La prevalenza alla nascita delle cardiopatie congenite (CHDs) varia da 5 a10 per 1.000 nati vivi. In Europa EUROCAT, il registro europeo delle malformazioni congenite che raccoglie dati da 21 registri regionali situati in 11 diversi paesi europei, riporta per il periodo 1980-1990 una prevalenza media alla nascita di 4,8 per 1.000 con un range compreso tra 1,8 (West Flanders) e 9,4 (Strasburgo). Questi dati rappresentano una sottostima della reale incidenza delle CHDs: studi epidemiologici condotti in epoca successiva a quella neonatale hanno dimostrato che solo il 50-60% delle CHDs viene diagnosticato nelle prime quattro settimane di vita.
Le CHDs sono patologie eziologicamente eterogenee; diverse sindromi mendeliane quali Holt Oram, Marfan e Williams sono caratterizzate da anomalie cardiache. Le CHDs sono spesso presenti in patologie cromosomiche, particolarmente nelle trisomie degli autosomi e nella sindrome di Turner; microdelezioni cromosomiche sono state inoltre eziologicamente correlate ad alcune sindromi quali la CATCH 22.
Nella news letter vengono presentati i dati relativi a 17 anni (1978-1994) di rilevazione e registrazione delle CHDs nella regione Emilia Romagna dal Registro IMER (Tabella 1)
|
Tabella |
1 |
Totali |
Isolate |
Associate |
MCA |
Cond.note |
An.Crom |
||||
|
Anni |
Nati |
N° |
Tasso Totali |
N° |
Tasso Isolate |
N° |
Tasso Associate |
N° |
N° |
N° |
|
|
1978 |
7.042 |
40 |
5,68 |
20 |
2,84 |
20 |
2,84 |
11 |
2 |
7 |
|
|
1979 |
6.365 |
24 |
3,77 |
17 |
2,67 |
7 |
1,10 |
3 |
|
4 |
|
|
1980 |
12.471 |
39 |
3,13 |
28 |
2,25 |
11 |
0,88 |
5 |
3 |
3 |
|
|
1981 |
14.322 |
47 |
3,28 |
29 |
2,02 |
18 |
1,26 |
8 |
1 |
9 |
|
|
1982 |
18.362 |
61 |
3,32 |
46 |
2,51 |
15 |
0,82 |
4 |
2 |
9 |
|
|
1983 |
21.767 |
91 |
4,18 |
73 |
3,35 |
18 |
0,83 |
12 |
3 |
3 |
|
|
1984 |
23.155 |
93 |
4,02 |
57 |
2,46 |
36 |
1,55 |
13 |
7 |
16 |
|
|
1985 |
24.016 |
95 |
3,96 |
68 |
2,83 |
27 |
1,12 |
10 |
5 |
12 |
|
|
1986 |
22.868 |
111 |
4,85 |
86 |
3,76 |
25 |
1,09 |
11 |
2 |
12 |
|
|
1987 |
22.741 |
101 |
4,44 |
76 |
3,34 |
25 |
1,10 |
9 |
7 |
9 |
|
|
1988 |
22.794 |
115 |
5,05 |
83 |
3,64 |
32 |
1,40 |
9 |
6 |
17 |
|
|
1989 |
23.386 |
110 |
4,70 |
80 |
3,42 |
30 |
1,28 |
14 |
5 |
11 |
|
|
1990 |
23.545 |
119 |
5,05 |
86 |
3,65 |
33 |
1,40 |
15 |
7 |
11 |
|
|
1991 |
25.129 |
126 |
5,01 |
102 |
4,06 |
24 |
0,96 |
14 |
2 |
8 |
|
|
1992 |
25.042 |
128 |
5,11 |
95 |
3,79 |
33 |
1,32 |
12 |
8 |
13 |
|
|
1993 |
24.533 |
146 |
5,95 |
108 |
4,40 |
38 |
1,55 |
22 |
8 |
8 |
|
|
1994 |
25.886 |
164 |
6,34 |
131 |
5,06 |
33 |
1,27 |
20 |
3 |
10 |
|
|
Totale |
343.424 |
1610 |
4,69 |
1185 |
3,45 |
425 |
1,24 |
192 |
71 |
162 |
|
La prevalenza media alla nascita nel periodo considerato è risultata pari al 4,7 per 1.000 (1.610/343.424 nati); questo dato risulta praticamente sovrapponibile al valore medio riportato da EUROCAT nel periodo 1980-1992.
La figura 1 mostra l’andamento temporale delle CHDs nella nostra regione.
I dati relativi agli anni 1978-79 si riferiscono ai soli nati nei primi tre centri partecipanti all’indagine, ovvero Bologna, Ferrara e Parma.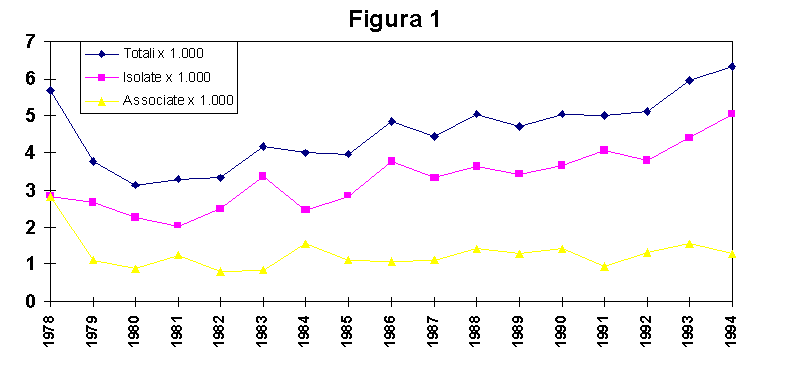
L’analisi del trend temporale nel periodo successivo evidenzia un costante aumento della prevalenza alla nascita delle CHDs. Come riportato nella figura 1, tale aumento è quasi totalmente imputabile all’incremento delle CHDs isolate - intendendo con tale termine i casi in cui il o i difetti cardiaci sono l’unica anomalia congenita rilevabile.
Per CHDs associate si intendono le cardiopatie associate ad altre malformazioni e possono essere rilevate in condizioni note (sindromi, sequenze o associazioni), anomalie cromosomiche o soggetti con patologia malformativa multipla (MCA).
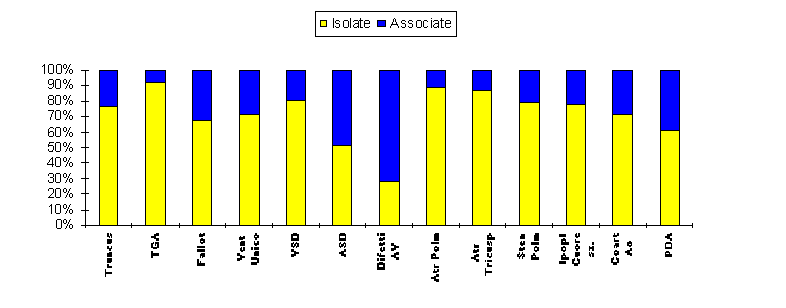
Nel periodo 1980-1994 sono stati identificati 1148 neonati ( 1148/ 1546; 74,26%) con sola patologia cardiaca (CHDs isolate) e 398 (25,74%) in cui era presente una anomalia extracardiaca (CHDs associate). La percentuale di CHDs isolate e associate a seconda del tipo di difetto cardiaco e’ riportata in figura 2.
Figura 2

Dalla figura risulta evidente come i difetti delle valvole atrio-ventricolari (difetti AV) risultano essere le cardiopatie che piu’ frequentemente vengono identificate in associazione con altre anomalie mentre la trasposizione dei grossi vasi (TGA), l’atresia polmonare (Atr Polm) e l’atresia della tricuspide (Atr Tricusp) sono quasi sempre CHDs isolate.
Le percentuale delle diverse CHDs isolate registrate nel periodo 1980-1994 è riportata in figura 3.
Figura 3
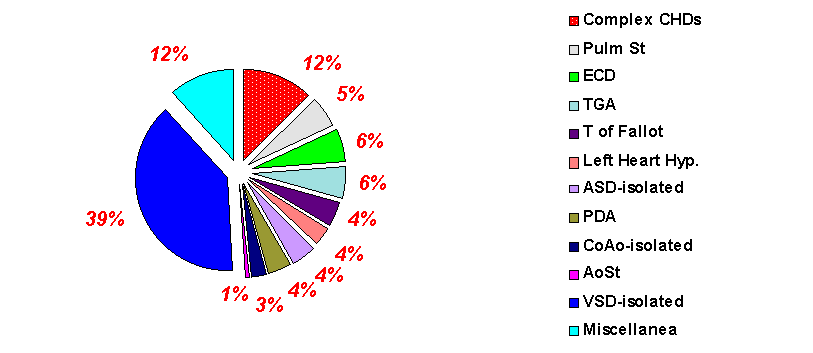
Nel periodo studiato i difetti interventricolari (VSD) sono risultati essere la CHD rilevata con maggior frequenza in assoluto; questo tipo di difetto inoltre rappresenta piu’ del 39% delle cardiopatie isolate.
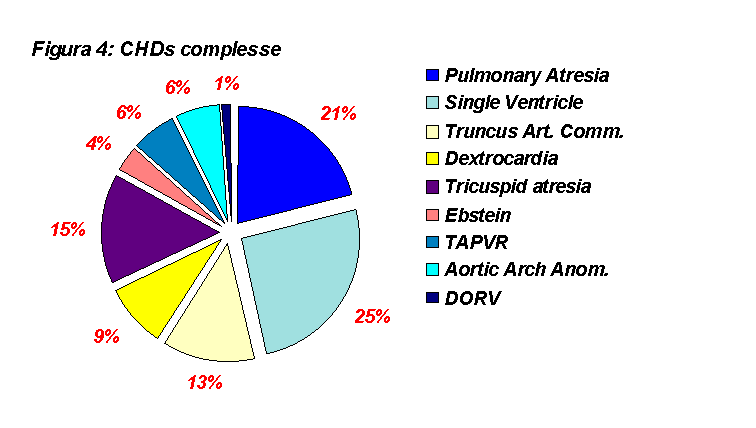
Le cardiopatie complesse costituiscono il 12% delle cardiopatie totali. Nella maggior parte dei casi rappresentano un carico notevole sia per le strutture sanitarie che per la famiglia del paziente. Come mostrato dalla figura 4 il cuore univentricolare e l’atresia polmonare rappresentano circa la metà delle CHDs complesse
Tra i fattori che hanno contribuito all’ aumento nella prevalenza delle CHDs nel periodo analizzato l’uso sempre piu’ diffuso dell’ecografia per il rilievo dei difetti congeniti, ed in particolare dell’ecocardiografia, riveste un ruolo importante.
Figura 5
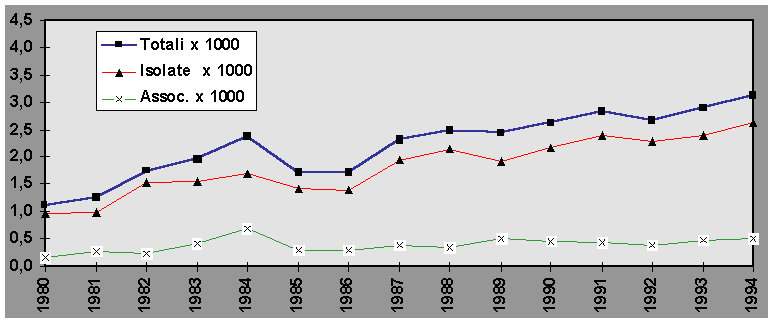
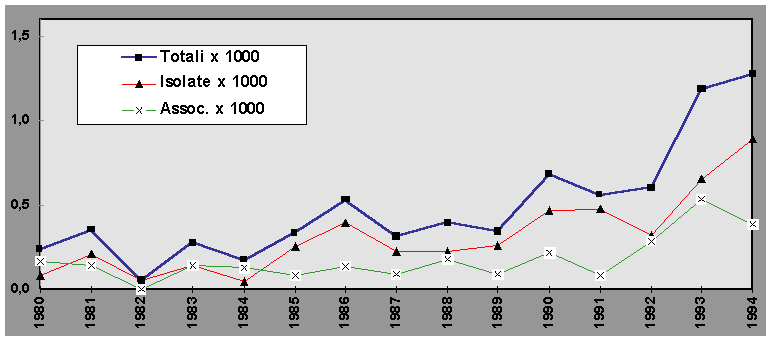
Infatti l’analisi del trend temporale dei VSD (figura 5) e dei difetti interatriali (ASD) (figura 5) evidenzia un aumento notevole della prevalenza alla nascita, passata per i VSD dal 11,2 per 10.000 nel 1980 al 31,3 per 10.000 nel 1994 (chi quadro=47,78; gl 14; p< 0,05), e per gli ASD dal 2,4 al 12,7 per 10.000 nello stesso periodo di tempo (chi quadro=75,18; gl 14; p<0,01).
Figura 6
Alcuni studi recenti di follow-up hanno evidenziato un tasso elevato di chiusura spontanea dei difetti interventricolari, passati da una percentuale del 50% al 75%. Risulta quindi alla fine spontaneo chiedersi se i piccoli difetti muscolari interventricolari identificati nel primo mese di vita costituiscano un vero difetto cardiaco o non siano piuttosto la dimostrazione di una semplice protrazione in epoca postnatale di un normale processo dello sviluppo.
L’analisi dei dati per provincia sarà oggetto della prossima news letter.
Bibliografia
Amati, F., Mari, A., Digilio, M.C., et al. 22q11 deletions in isolated and syndromic patients with tetralogy of Fallot. Hum.Genet. 95:479-482, 1995.
Anderson, P.A. The molecular genetics of cardiovascular disease. Curr.Opin.Cardiol. 10:33-43, 1995.
Basson, C.T., Solomon, S.D., Weissman, B., et al. Genetic heterogeneity of heart-hand syndromes. Circulation 91:1326-1329, 1995.
Bleyl, S., Nelson, L., Odelberg, S.J., et al. A gene for familial total anomalous pulmonary venous return maps to chromosome 4p13-q12. Am.J.Hum.Genet. 56:408-415, 1995.
Digilio, M.C., Marino, B., Formigari, R. and Giannotti, A. Maternal diabetes causing DiGeorge anomaly and renal agenesis [letter]. Am.J.Med.Genet. 55:513-514, 1995.
Grace, A.A. and Gruber, P.J. Understanding cardiovascular development (news). Lancet 345:915-916, 1995.
Johnson, M.C., Strauss, A.W., Dowton, S.B., et al. Deletion within chromosome 22 is common in patients with absent pulmonary valve syndrome. Am.J.Cardiol. 76:66-69, 1995.
Morrow, B., Goldberg, R., Carlson, C., et al. Molecular definition of the 22q11 deletions in velo-cardio-facial syndrome. Am.J.Hum.Genet. 56:1391-1403, 1995.
Payne, R.M., Johnson, M.C., Grant, J.W. and Strauss, A.W. Toward a molecular understanding of congenital heart disease. Circulation 91:494-504, 1995.
Sadiq, M., Stumper, O., Wright, J.G., De Giovanni, J.V., Billingham, C. and Silove, E.D. Influence of ethnic origin on the pattern of congenital heart defects in the first year of life. Br.Heart J. 73:173-176, 1995.
Shipp, T.D., Bromley, B., Hornberger, L.K., Nadel, A. and Benacerraf, B.R. Levorotation of the fetal cardiac axis: a clue for the presence of congenital heart disease. Obstet.Gynecol. 85:97-102, 1995.
Stone, A. Connexin knockout provides a link to heart defects [news; comment]. Science 267:17731995.
Tikanoja, T. Effect of technical development on the apparent incidence of congenital heart disease [letter]. Pediatr.Cardiol. 16:100-101, 1995.
Allan, L.D., Sharland, G.K., Milburn, A., et al. Prospective diagnosis of 1,006 consecutive cases of congenital heart disease in the fetus. J.Am.Coll.Cardiol. 23:1452-1458, 1994.
Anderson, P.A. Cardiovascular molecular genetics. Curr.Opin.Cardiol. 9:78-90, 1994.
Bleyl, S., Ruttenberg, H.D., Carey, J.C. and Ward, K. Familial total anomalous pulmonary venous return: a large Utah-Idaho family. Am.J.Med.Genet. 52:462-466, 1994.
Bouvagnet, P., Sauer, U., Debrus, S., et al. Deciphering the molecular genetics of congenital heart disease. Herz. 19:119-125, 1994.
Bower, C. and Ramsay, J.M. Congenital heart disease: a 10 year cohort. J.Paediatr.Child Health 30:414-418, 1994.
Brent, R.L. Cardiovascular birth defects and prenatal exposure to female sex hormones: importance of utilizing proper epidemiological methods and teratologic principles. Teratology 49:159-161, 1994.
Correa Villasenor, A., Ferencz, C., Neill, C.A., Wilson, P.D. and Boughman, J.A. Ebstein's malformation of the tricuspid valve: genetic and environmental factors. The Baltimore-Washington Infant Study Group. Teratology 50:137-147, 1994.
Devriendt, K., Casaer, A., Van Cauter, A., et al. Asplenia syndrome and isolated total anomalous pulmonary venous connection in siblings. Eur.J.Pediatr. 153:712-714, 1994.
Driscoll, D.A. Genetic basis of DiGeorge and velocardiofacial syndromes. Curr.Opin.Pediatr. 6:702-706, 1994.
Gersony, W.M. Ventricular septal defect and left sided obstructive lesions in infants. Curr.Opin.Pediatr. 6:596-599, 1994.
Giannotti, A., Digilio, M.C., Marino, B., Mingarelli, R. and Dallapiccola, B. Cayler cardiofacial syndrome and del 22q11: part of the CATCH22 phenotype [letter]. Am.J.Med.Genet. 53:303-304, 1994.
Gillum, R.F. Epidemiology of congenital heart disease in the United States. Am.Heart J. 127:919-927, 1994.
Hanna, E.J., Nevin, N.C. and Nelson, J. Genetic study of congenital heart defects in Northern Ireland (1974-1978). J.Med.Genet. 31:858-863, 1994.
Khalil, A., Aggarwal, R., Thirupuram, S. and Arora, R. Incidence of congenital heart disease among hospital live births in India. Indian Pediatr. 31:519-527, 1994.
Levy Mozziconacci, A., Wernert, F., Scambler, P., et al. Clinical and molecular study of DiGeorge sequence. Eur.J.Pediatr. 153:813-820, 1994.
Maher, J.E., Colvin, E.V., Samdarshi, T.E., Owen, J. and Hauth, J.C. Fetal echocardiography in gravidas with historic risk factors for congenital heart disease. Am.J.Perinatol. 11:334-336, 1994.
Matsuoka, R., Takao, A., Kimura, M., et al. Confirmation that the conotruncal anomaly face syndrome is associated with a deletion within 22q11.2. Am.J.Med.Genet. 53:285-289, 1994.
Meberg, A., Otterstad, J.E., Froland, G., Sorland, S. and Nitter Hauge, S. Increasing incidence of ventricular septal defects caused by improved detection rate. Acta Paediatr. 83:653-657, 1994.
Nora, J.J. From generational studies to a multilevel genetic-environmental interaction [editorial; comment]. J.Am.Coll.Cardiol. 23:1468-1471, 1994.
Olshan, A.F., Schnitzer, P.G. and Baird, P.A. Paternal age and the risk of congenital heart defects. Teratology 50:80-84, 1994.
Pradat, P. Recurrence risk for major congenital heart defects in Sweden: a registry study. Genet.Epidemiol. 11:131-140, 1994.
Rein, A.J. and Sheffer, R. Genetics of conotruncal malformations: further evidence of autosomal recessive inheritance [letter]. Am.J.Med.Genet. 50:302-303, 1994.
Roy, D.L., McIntyre, L., Human, D.G., et al. Trends in the prevalence of congenital heart disease: comprehensive observations over a 24-year period in a defined region of Canada. Can.J.Cardiol. 10:821-826, 1994.
Sapin, S.O., Junkel, P.A., Wong, A.L. and Simandle, R.G. The congenital isolated apical ventricular septal defect. Pediatrics 93:516-518, 1994.
Schulze Neick, I., Hausdorf, G. and Lange, P.E. Maldevelopment of conotruncal and aorto-pulmonary septum with absent left central pulmonary artery: anatomical and clinical implications. Br.Heart J. 71:89-91, 1994.
Seaver, L.H., Pierpont, J.W., Erickson, R.P., Donnerstein, R.L. and Cassidy, S.B. Pulmonary atresia associated with maternal 22q11.2 deletion: possible parent of origin effect in the conotruncal anomaly face syndrome. J.Med.Genet. 31:830-834, 1994.
Tikkanen, J. and Heinonen, O.P. Risk factors for hypoplastic left heart syndrome. Teratology 50:112-117, 1994.
Wang, S., Li, S. and Zhao, Y. [The study of the dangerous factors of the simple heart disease in children and its action mode]. Chung.Hua.Liu.Hsing.Ping.Hsueh.Tsa.Chih. 15:304-307, 1994.
Whittemore, R., Wells, J.A. and Castellsague, X. A second-generation study of 427 probands with congenital heart defects and their 837 children [see comments]. J.Am.Coll.Cardiol. 23:1459-1467, 1994.
Wiseman, R.A. Comments on "Cardiovascular birth defects and prenatal exposure to female sex hormones" [comment]. Teratology 49:172-173, 1994.